¿Están las células vivas sometidas a las leyes químicas?
Juan Carlos Aledo y Alicia Esteban
No es nuestro propósito resucitar la teoría vitalista y sería
absurdo pensar que la pregunta que da título a este breve artículo
tiene una intencionalidad más allá de la puramente retórica.
Aunque la respuesta a esta pregunta sea afirmativa, la propia naturaleza
de estas leyes químicas nos debería hacer reflexionar sobre
su aplicabilidad en determinadas condiciones. Presentar algunos datos que
nos induzcan a tal reflexión es el objetivo de este artículo.
Hasta mediados del siglo XIX eran mayoría los científicos
que pensaban que la vida era un fenómeno especial, que no tenía
por qué obedecer las leyes físico-químicas que gobiernan
a los objetos inanimados. Esta creencia, conocida como vitalismo, sostenía
que era indispensable el concurso de una fuerza vital? para que se dieran
las reacciones que tienen lugar en los organismos vivos. Así, por
ejemplo, en 1860 Luis Pasteur sostenía que la fermentación
alcohólica que realizaban las células de levadura era un
proceso inextricablemente ligado con la estructura y la vida de dichas
células. No obstante, la teoría vitalista había comenzando
un lento declive 32 años antes, cuando el químico alemán
Wöhler lograra sintetizar urea, un compuesto orgánico, en un
tubo de ensayo, ¡sin la participación de ningún organismo
vivo!
Una vez los biólogos se convencieron de que el estudio del fenómeno
vital podía abordarse con metodología química, el
avance de la biología ha sido espectacular. El descubrimiento del
ADN como material genético y de su estructura en doble hélice
junto con la interpretación del código genético sean
quizás algunos de los hitos más divulgados, pero desde luego
no son los únicos. En definitiva, hoy día poseemos un importante
conocimiento a nivel molecular de muchos de los procesos fundamentales
de la biología. Sin embargo, por muchos e importantes que sean los
logros cosechados por la bioquímica, es conveniente reconocer los
límites de la aproximación química a los problemas
biológicos.
La naturaleza estadística de las leyes químicas
Una de las primeras cosas que aprendemos en química, es
la existencia de átomos y moléculas. Más aún,
se nos enseña que toda la materia, y no hay razón para excluir
la materia viva, está constituida por átomos y moléculas
individuales. Por lo tanto, podremos afirmar que la materia está
formada por un número determinado de partículas discretas.
Podríamos, pues, razonar de la siguiente forma: toda ley química
expresada en forma de una ecuación matemática, debería
manejar cualquier término referente a masa como una variable discreta.
Sin embargo, sabemos que este no es el caso. Por ejemplo, en las ecuaciones
cinéticas empleamos la concentración como una variable matemática
continua. La materia es discreta pero en la leyes químicas se maneja
como si de una variable continua se tratara, ¿por qué?
Una respuesta satisfactoria para esta cuestión proviene de la
mecánica estadística. Las moléculas están sujetas
a un continuo movimiento térmico que hace imposible que los acontecimientos
que tienen lugar entre un número pequeño de moléculas
puedan ser reducidos a leyes formuladas como ecuaciones matemáticas.
Sólo cuando contamos con un número de moléculas suficientemente
grande, las leyes estadísticas empiezan a ser fiables, describiendo
el comportamiento de este conjunto grande de moléculas con una precisión
que aumenta conforme lo hace el número de moléculas involucradas.
Pongamos nuevamente un ejemplo de cinética química; para
una reacción simple del tipo A -> B, podemos determinar con precisión
cuánto tiempo se requiere para que un determinado porcentaje de
moléculas A se conviertan en B (este tiempo es lo que llamaríamos
vida media, t1/2, cuando el porcentaje
en cuestión fuera el 50 %). Ahora bien, en las mismas condiciones,
si nos fijamos en una única molécula de A, resulta imposible
determinar el tiempo que ésta va a requerir para convertirse en
B. Así, pues, la validez de las leyes químicas es sólo
aproximada. Su aparente infalibilidad se debe únicamente al enorme
número de moléculas que generalmente cooperan en cualquier
proceso químico. La relación que existe entre el número
de moléculas y la precisión de una ley química se
ilustra en la siguiente figura.
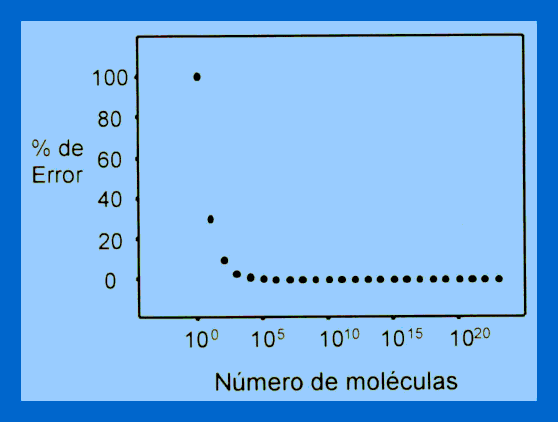
Por insistir algo más en la cuestión de los números,
cuando tenemos un mol de una sustancia (6,02 1023
moléculas) participando en cualquier proceso químico, la
ley que manejemos para describir tal proceso será tan precisa que
su margen de error se reduce a un 10-10
%, es decir, prácticamente cero. Sin embargo, si en ese mismo proceso
tenemos involucradas 104 moléculas,
en este caso el error puede ser del 1 %, valor nada despreciable para tratarse
de una ley de la Naturaleza. Ocurre que en los procesos que los químicos
suelen estudiar, el número de moléculas implicadas es bastante
elevado, haciendo que las leyes químicas sean muy precisas. ¿Cabe
esperar lo mismo en el caso de las reacciones biológicas?
Los procesos químicos en el interior de las células
vivas
La mayoría de las reacciones biológicas que estudiamos
en el laboratorio, se realizan in vitro, es decir, las células
se rompen para que liberen su contenido en un tubo de ensayo donde se lleva
a cabo el estudio. Como el número de células de las que partimos
es muy elevado (del orden de millones), el número de moléculas
que participan en la reacción objeto de estudio será también,
cuando menos, del orden de millones. Por supuesto que, en estas condiciones,
las leyes químicas conocidas son del todo exactas. Pero la cuestión
no era ésta, la cuestión es si esas misma leyes gobiernan
también las reacciones que tienen lugar en el interior de una célula
viva. Para responder tendríamos que conocer el número de
moléculas que se ven implicadas en las reacciones que se dan en
el interior de una célula viva. Para ello consideremos algunos datos
de interés.
En una célula encontramos muchos tipos distintos de biomoléculas,
unas estarán representadas en mayor número y otras menos.
Tomemos, por ejemplo, una sustancia cualquiera que llamaremos S, cuya concentración
intracelular sea de 10-8 M. Ésta
es una concentración muy pequeña pero dentro del rango en
el cual muchos sistemas biológicos muestran actividad in vitro.
Tenemos una concentración, necesitamos un volumen y podremos calcular
cuántas moléculas tenemos. Para una célula bacteriana
típica, se estima un volumen interno de 2 10-16
litros. Podemos calcular que en el interior de nuestra célula
bacteriana tenemos 2 10-24 moles de S.
Como un mol son 6.02 1023 moléculas,
tendremos ¡tan sólo 1 molécula de S por célula!
Para terminar con los datos, vamos a dar uno que no requiere de cálculos
por nuestra parte. Se trata de la proteína represora del operon
lac de Escherichia coli, que según los libros de textos (véase
por ejemplo, Genética de Ursula Goodenogh) está presente
en las células en un número próximo a 10. Aunque los
datos que hemos presentado están referidos a bacterias, lo mismo
sería aplicable a células eucariotas, las cuales aunque presenten
un mayor volumen también poseen una mayor diversidad de biomoléculas
que además se pueden encontrar en orgánulos, como mitocondrias
o cloroplastos, que suponen compartimentos de tamaño similar al
de una célula bacteriana.
¿A dónde nos conduce todo esto? Hemos visto por un lado,
que las leyes químicas basadas en la mecánica estadística
requieren un gran número de moléculas para que sean lo suficientemente
precisas como para recibir la categoría de ley. Por otro lado, hemos
visto que muchas biomoléculas están representadas en el interior
celular por no mucho más que un puñado de las mismas. Si
relacionamos una cosa con la otra, quizás debiéramos pensárnoslo
dos veces antes de aplicar, por ejemplo, la ley de acción de masas
a cualquier proceso celular.
Juan Carlos Aledo es Profesor Asociado y Alicia Esteban es becaria
de F.P.I., ambos en el Departamento de Biología Molecular y Bioquímica
de la Universidad de Málaga
