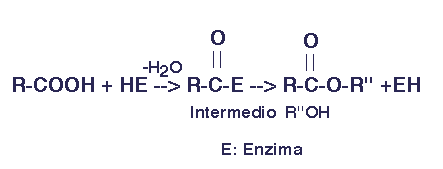

El mecanismo general de catálisis de las lipasas, independientemente del disolvente, se esquematiza en la Figura 2 (tomado de Andersch.P, et al. (1997), Ester Synthesis via acyl Transfer. Methods in Enzimology 286 pp. 406-443):
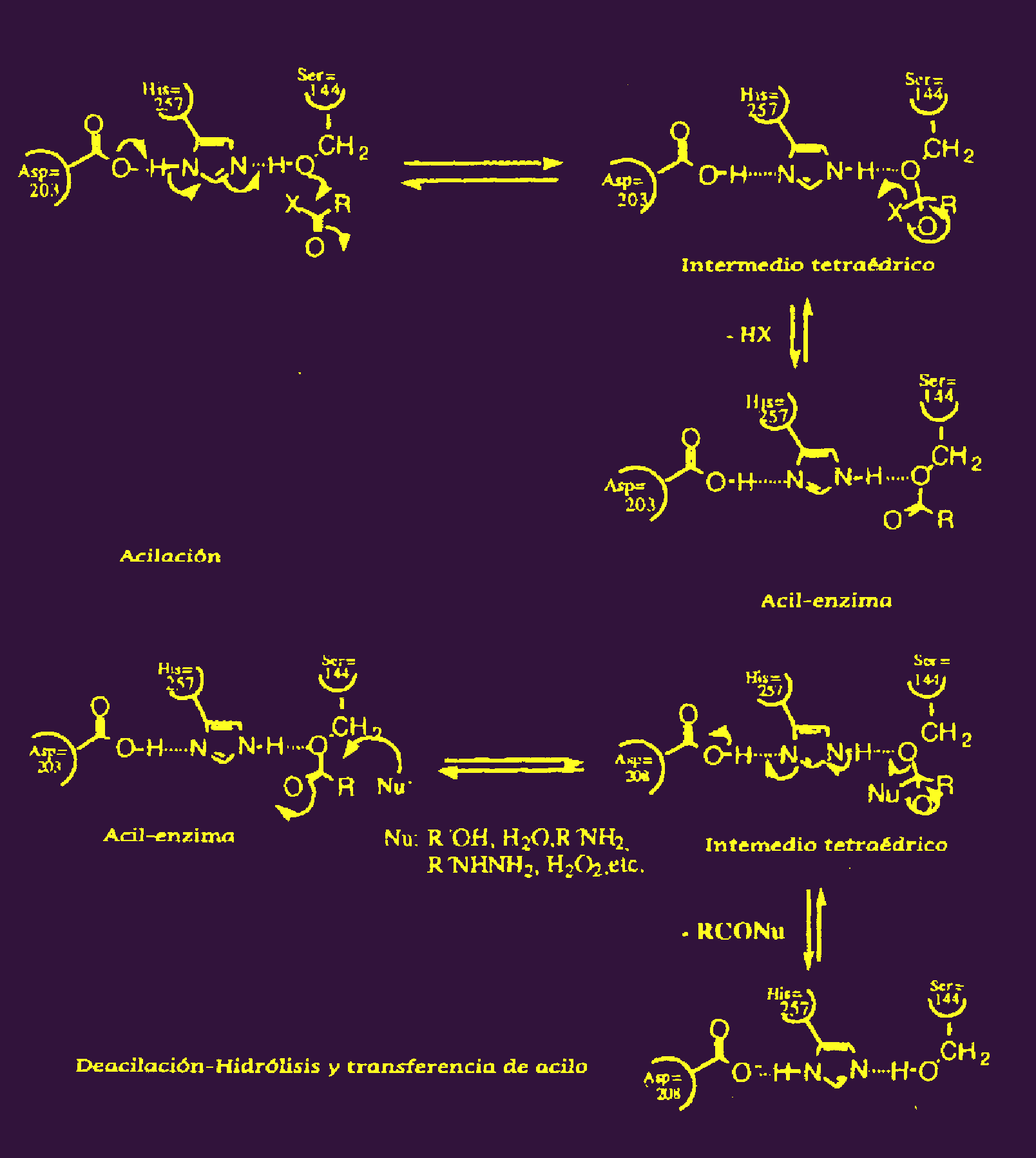
En este esquema el compuesto R-COX es el sustrato el cual sufre un
ataque nucleófilo por parte del oxígeno de una serina de
la triada catalítica, produciéndose un cambio de hibridación
en el átomo de carbono del grupo carbonilo. De este modo se produce
el intermedio tetraédrico. Por medio de una reacción de acilación
se produce eliminación de la especie química HX formándose
el intermedio acil-enzima, el cual es susceptible de sufrir un nuevo ataque
nucleofílico por parte de diferentes especies moleculares nucleófilas
que, según su naturaleza, conducirá a distintos tipos de
reacciones.
De este modo, si el nucleófilo es R1OH, dará lugar a
una esterificación, dando como resultado de la reacción el
producto RCOOR1. Si ataca como nucleófilo el sustrato R1NH2, se
obtiene RCONHR1 (amida). Si como nucleófilo ataca un tiol, R1SH,
se daría la reacción de tioesterificación, produciéndose
como producto la especie RCOSR1. Cuando actúa como nucleófilo
H2O, se produce una hidrólisis, dando lugar a RCOOH (ácido
carboxílico).De esta forma, dependiendo de cual sea el tipo de nucleófilo
dará diversos tipos de reacciones y como consecuencia de ello se
producirá diferentes productos. Finalmente, siempre que el nucleófilo
actua sobre el complejo acil-enzima, se produce un intermedio tetraédrico,
con el correspondiente cambio de hibridación del carbono. Cuando
se elimina el producto de reacción RCONu, la triada catalítica
vuelve a su estado original, de forma que queda a disposición del
sustrato para actuar nuevamente. Como puede apreciarse la conocida capacidad
hidrolítica de las lipasas se lleva a cabo en presencia de agua
y es sólo una de las distintas e importantes reacciones que son
capaces de llevar a cabo.
Las aplicaciones actuales de lipasas esteroespecíficas son,
entre otras, la preparación de ésteres y alcoholes ópticamente
activos por medio de una reacción de transesterificación
en medio orgánico, como la formación de (-)-3-metoxi-1-butilpropanoato
a partir de metilpropanoato y 3-metoxi-1-butanol, como reactivos. Además,
la preparación enzimática de alcoholes y ésteres ópticamente
activos, pueden ser convertidas químicamente en otros compuestos
ópticamente activos, como (R)-(+)-óxido de propileno en la
síntesis de (R)-reciferolido o á-metileno-÷-lactonas
quirales y de (S)-(-)-óxido de propileno para la producción
de (S)-sulcatol. Estos productos tienen gran interés en la ruta
de síntesis de una gran variedad de fármacos. Por último,
señalar que otra importante aplicación biotecnológica
de estos biocatalizadores es la síntesis de polímeros ópticamente
activos, en particular poliesteres a partir de diesteres y dioles. En las
condiciones anhidras apropiadas, la transesterificación entre los
anteriores compuestos da lugar a poliesteres de unos 25 kD de peso molecular.
Sonia Osorio Algar es estudiante de 5º Curso de Químicas. Antonio Heredia es Profesor Titular de Bioquímica en la Universidad de Málaga.