b
-catenina y la formación de las válvulas cardiacasRamón Muñoz-Chápuli
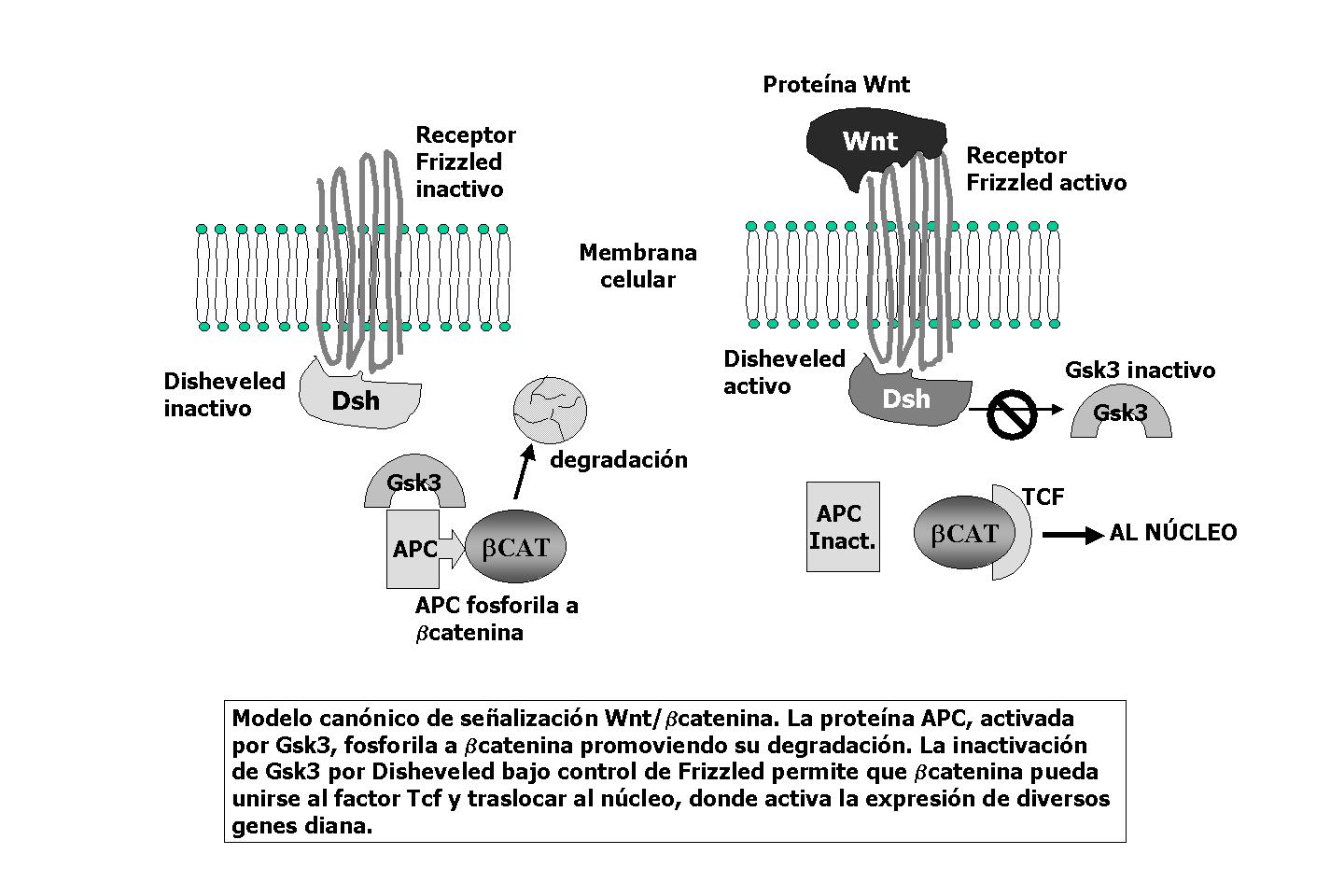
No es la primera vez, y seguro que tampoco será la última, que se habla de la proteína b-catenina en las páginas de Encuentros en la Biología. En otras ocasiones se ha comentado el descubrimiento y las funciones de su homólogo en un organismo unicelular, Dyctiostelium discoideum (Encuentros, núm. 69), o el papel que podría desempeñar en la inducción de la cresta neural (Encuentros, núm. 85). Recordemos que b-catenina es una de las proteínas que participan en la unión de las cadherinas (moléculas de adhesión intercelular) al citosqueleto. Lo que la hace especialmente importante es que cuando la b-catenina se encuentra libre en el citoplasma, no ligada a uniones intercelulares, es susceptible de unirse al factor Tcf, traslocar al núcleo y actuar como factor de transcripción, activando la expresión de numerosos genes implicados en múltiples procesos celulares. Esto quiere decir que la presencia de b-catenina libre debe estar exquisitamente regulada. En condiciones normales, en células adultas, la proteína APC fosforila a b-catenina, marcándola para su ubiquitinación y promoviendo así su degradación. Esta es la causa de que mutaciones que afectan a esa función de APC puedan tener consecuencias funestas. De hecho el nombre de la proteína (Adenomatous Polyposis Coli) ya indica su implicación en la formación de pólipos intestinales que pueden conducir al cáncer de colon. APC, por tanto, se considera un supresor tumoral.
En determinadas circunstancias del desarrollo b-catenina debe translocar al núcleo para activar determinados procesos. Este es el caso de la especificación del eje dorsoventral de anfibios o del mesodermo de erizos de mar, o muchos otros procesos en los que la entrada de b-catenina en el núcleo representa una señal esencial. En estos casos existe un mecanismo que inactiva la función controladora de APC y estabiliza b-catenina en el citoplasma. Dicho mecanismo está regulado por factores secretados pertenecientes a la familia Wnt, ligandos de receptores Frizzled, situados en la superficie celular. Frizzled está acoplado a una proteína, Disheveled, que resulta activada por la unión de Frizzled a su ligando. Disheveled, cuando está activa, inactiva un enzima del metabolismo de la glucosa (GSK3) que, curiosamente, es imprescindible para que APC fosforile a b-catenina y para la degradación de esta última. En definitiva, y aunque esto sea un simplificación de un proceso mucho más complejo, la señal Wnt va implicar que la forma libre de la b-catenina no sea degradada y pueda entrar en el núcleo. Hasta tal punto este mecanismo es activo, que basta con inhibir la enzima GSK3 en la zona ventral de un embrión de anfibio para que no sólo esa zona se reespecifique como dorsal, sino que además se crea un nuevo centro organizador, un segundo eje corporal y, en definitiva, una pareja de renacuajos siameses unidos por su parte ventral.

APC, por tanto, además de su papel como supresor tumoral, es importante en el desarrollo. De hecho, ratones con una variante truncada de APC, en los que la vía de señales mediada por b-catenina está constitutivamente activa, no llegan a completar la gastrulación en homocigosis y desarrollan tumores intestinales en heterocigosis (Fodde et al., PNAS, 91, 8969 [1994]).
Por este motivo puede resultar sorprendente el resultado recién publicado acerca de una mutación con pérdida de función de APC en el pez cebra (Hurlstone et al., Nature 425, 633 [2003]). Los peces cebra sin APC funcional completan la gastrulación y avanzan en la organogénesis, aunque muestran un gran número de malformaciones en ojos, oídos, mandíbulas, vísceras, etc. La causa de la muerte es probablemente una insuficiencia cardiaca de la que hablaremos luego. Una cuestión que sí es importante es explicar cómo los peces cebra superan las fases críticas de la gastrulación y la formación del mesodermo, fases en las que las señales mediadas por b-catenina se han revelado como esenciales. La respuesta probablemente hay que buscarla en la presencia de proteína APC materna en el ovocito. Hay que recordar que en los embriones de mamíferos la expresión de genes cigóticos es muy temprana, comienza prácticamente tras la primera segmentación. En cambio, en los grandes ovocitos de peces o anfibios existe una importante cantidad de mRNA de origen materno, lógicamente no afectado por la mutación que pueda existir en el núcleo del cigoto. Es probable que la síntesis de proteína APC procedente de dicho mRNA materno mantenga bajo control a b-catenina hasta que las reservas se agotan, comienza a transcribirse el gen mutado, un gen que produce APC defectuoso, y con ello se precipita la entrada al núcleo de b-catenina y las malformaciones.
Sea cual sea la explicación, lo importante es que estos resultados han puesto de relieve la implicación de la vía de señalización mediada por b-catenina en el desarrollo cardiaco. Lo que ocurre en el pez cebra deficiente en APC es una malformación de las válvulas cardiacas. Estas válvulas, que impiden el reflujo de sangre de una cámara a otra, se forman, básicamente, a partir de un mesénquima derivado de la transformación localizada del endocardio. El endocardio está formado por células endoteliales, pero es bien conocido que en zonas muy concretas del corazón (tracto de salida y canal atrioventricular) células endoteliales se transforman en un mesénquima que puebla la matriz extracelular subyacente, produce componentes fibrosos de la matriz y después de un complicado proceso de remodelación, forma las válvulas cardiacas. Se sabe también que determinadas moléculas, como los factores de crecimiento de la superfamilia TGFb, están implicadas en la señal que desde el miocardio induce la transformación localizada del endocardio. De forma inesperada, el experimento de inactivación de APC en pez cebra ha implicado también a b-catenina y probablemente la vía de los Wnts, en este proceso. En peces cebra normales, sólo las células que van a transformarse en el mesénquima de las válvulas cardiacas muestran la presencia de b-catenina en el núcleo, mientras que en el resto del endocardio b-catenina se encuentra asociado a las uniones intercelulares (probablemente a la VE-cadherina, una forma específica de cadherina en el endotelio). En cambio, en los mutantes de APC, b-catenina entra en el núcleo de todas las células endocárdicas, lo que implica una masiva transformación a mesénquima. La cavidad cardiaca se ve, por tanto, obliterada por una gran cantidad de tejido valvular sin remodelar, causando insuficiencia cardiaca y la muerte de los embriones.
Queda clara, por tanto, la implicación de b-catenina en la formación de las válvulas cardiacas, pero esta respuesta inesperada no hace más que generar muchas preguntas. ¿Es suficiente una señal Wnt para iniciar la valvulogénesis cardiaca? ¿Qué relación existe entre las señales TGFb ya identificadas como promotoras de la transición y la vía de señales Wnt/b-catenina? ¿Cuáles son las dianas de b-catenina en el núcleo de las células endocárdicas? ¿Quizá genes implicados en la transformación epitelio-mesénquima, tales como Snail? Podríamos decir, metafóricamente, que la unión de Wnt con su receptor en el endocardio ha desencadenado una auténtica cascada de preguntas.
Ramón Muñoz-Chápuli es Catedrático de Biología Animal en la UMA